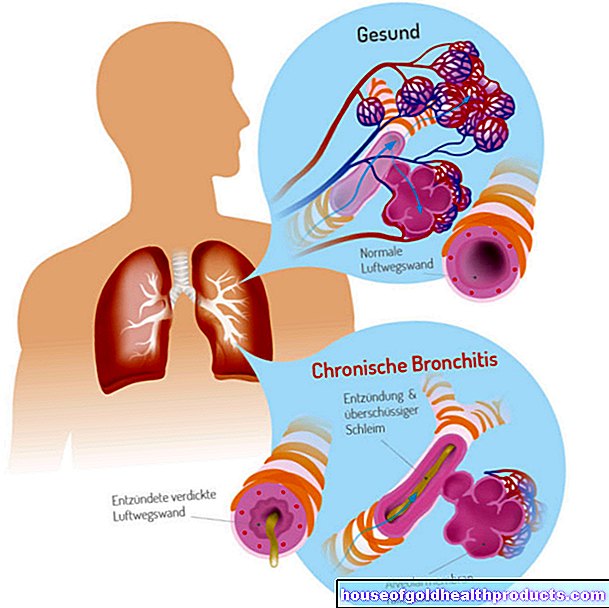
Remdesivir: Otoritas UE merekomendasikan persetujuan
Florian Tiefenböck belajar kedokteran manusia di LMU Munich. Dia bergabung dengan sebagai mahasiswa pada Maret 2014 dan telah mendukung tim editorial dengan artikel medis sejak saat itu. Setelah menerima lisensi medis dan kerja praktek penyakit dalam di University Hospital Augsburg, ia telah menjadi anggota tetap tim sejak Desember 2019 dan, antara lain, memastikan kualitas medis alat
Lebih banyak posting oleh Florian Tiefenböck Semua konten diperiksa oleh jurnalis medis.Pencarian obat yang cocok untuk melawan virus corona Sars-CoV-2 terus berlanjut. Sekarang, untuk pertama kalinya, European Medicines Agency (EMA) telah merekomendasikan obat untuk pengobatan pasien Covid 19 untuk persetujuan bersyarat: Remdesivir.
Menurut pernyataan resmi dari European Medicines Agency (EMA) pada hari Kamis, badan tersebut merekomendasikan persetujuan terbatas untuk remdesivir (nama dagang Veklury). Oleh karena itu, Remdesivir harus disetujui untuk pengobatan Covid-19 pada orang dewasa dan remaja berusia 12 tahun ke atas. Namun, ini hanya berlaku jika orang yang terkena telah mengembangkan pneumonia dari Sars-CoV-2 dan membutuhkan oksigen tambahan.
Komisi UE masih harus menyetujui rekomendasi sebelum bahan aktif dapat ditempatkan di pasar Eropa dalam kerangka persetujuan ini. Menurut siaran pers, Komisi akan memutuskan hal ini dalam minggu mendatang.
Persetujuan jalur cepat
Rekomendasi saat ini adalah apa yang disebut "persetujuan bersyarat" dari bahan aktif. Ini dapat digunakan ketika kebutuhan untuk pengobatan sangat besar, tetapi data tentang keefektifan dan manfaat belum tersedia sejauh yang biasanya diperlukan.
Sejak 30 April, Komite Produk Obat untuk Penggunaan Manusia secara bertahap mengevaluasi data sementara yang dikumpulkan dan sebagian dari tes non-klinis, studi dan program penggunaan penuh kasih. Mereka diajukan oleh produsen obat yang sekarang direkomendasikan, perusahaan biotek AS Gilead Sciences. Pabrikan mengajukan aplikasi untuk persetujuan pada tanggal 5 Juni.
Setelah persetujuan yang sekarang direkomendasikan, EMA menuntut data lebih lanjut dari produsen tentang manfaat dan keamanan remdesivir pada akhir tahun. Perusahaan harus menyerahkan bukti kualitas, tetapi juga data tingkat kematian, pada akhir Agustus.
Siapa yang harus remdesivir bantu?
Menurut pendapatnya, badan tersebut terutama bergantung pada studi NIAID-ACTT-1, yang didanai oleh Institut Alergi dan Penyakit Menular AS. Para ahli juga berkonsultasi dengan data dari penelitian lain sebagai pendukung.
Pada akhirnya, mereka sampai pada kesimpulan bahwa obat itu lebih bermanfaat daripada berbahaya bagi pasien yang sakit parah dengan Covid-19. Mereka merujuk pada orang-orang yang telah mengembangkan pneumonia dan yang membutuhkan pasokan oksigen tambahan.
Dalam penelitian di atas, total 1000 orang diperiksa. Para dokter merawat pasien dalam satu kelompok studi dengan remdesivir (10 hari) dan mereka di kelompok lain dengan plasebo. Ditemukan bahwa pasien yang diobati dengan remdesivir telah pulih sekitar empat hari lebih awal daripada peserta dalam kelompok plasebo.
Namun, efeknya hanya terlihat pada pasien Covid 19 yang sakit parah. Waktu pemulihan tetap sama untuk pasien dengan tingkat keparahan penyakit ringan atau sedang. Bahkan pada pasien yang sudah berventilasi dan darahnya telah diperkaya dengan oksigen melalui apa yang disebut oksigenasi ekstrakorporeal (ECMO), menurut data sejauh ini, tidak ada manfaat dari pengobatan remdesivir.
Penggunaan sebelumnya
Remdesivir awalnya dikembangkan untuk mengobati demam Ebola. Sebagai obat Covid-19, sejauh ini telah digunakan di Amerika Serikat dan Jepang, antara lain. Pabrikan Jepang telah menyetujui Gilead pada awal Mei lalu. Di Jerman juga, Remdesivir diberikan sesuai dengan rekomendasi EMA: Untuk orang yang sakit parah sebagai bagian dari apa yang disebut program penggunaan welas asih - jika orang yang bersangkutan tidak lagi memiliki pilihan pengobatan lain.
Tag: kehamilan obat perjalanan RSUD













.jpg)